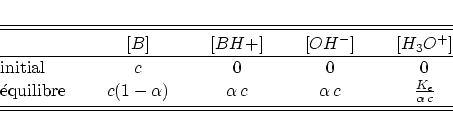
Le tableau d'avancement devient
![\begin{displaymath}K_a = {{[H_3O^+]\cdot[B]}\over{[BH^+]}} =
{{K_e [B]}\over{[OH^-]\cdot[BH^+]}} \end{displaymath}](img58.png)
Comme pour l'acide fort nous supposons que la réaction de la base avec l'eau
est totale, c'est-à-dire toutes les molécules ![]() se protonent et donnent
se protonent et donnent
![]() et
et ![]() .
. ![]() est donc
est donc
Le raisonnement de ![]() nous amène au même résultat.
nous amène au même résultat.
Pour utiliser éq. 9 pour la solution exacte il faut faire
attention au fait qu'une base forte a un acide conjugé très faible,
qui ne réagit pas avec l'eau (espèce spectateur). Par ailleurs,
Equation 8 devient dans le cas d'une base (
![]() la condition
la condition
![]() . Il faut donc re-dériver une
équation équivalente à équation
9 à partir des quatres équations, cette fois-ci avec
. Il faut donc re-dériver une
équation équivalente à équation
9 à partir des quatres équations, cette fois-ci avec ![]() au lieu de
au lieu de ![]() . Nous ne le ferons pas ici.
. Nous ne le ferons pas ici.