


Next: About this document ...
Up: Une note concernant les
Previous: Base forte
Dans la cas d'une base faible nous supposons que le taux de protonation
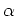 est faible, donc
est faible, donc ![$[B]\approx c$](img63.png) . De même
. De même
![$[OH^-]\approx [BH^+]$](img64.png) à
cause de l'électroneutralité. Avec ces deux hypothèses nous arrivons à
:
à
cause de l'électroneutralité. Avec ces deux hypothèses nous arrivons à
:
De cette relation nous obtenons
![$[H_3O^+] = \sqrt{K_a K_e / c}$](img66.png) ou bien
ou bien
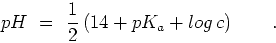 |
(13) |
Pour utiliser le taux 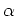 nous écrivons
nous écrivons
et ensuite
d'où nous obtenons tout de suite la relation pour le pH d'équation
13.
Peter Reinhardt
2006-04-24
![\begin{displaymath}K_a = {{[B]\cdot[H_3O^+]}\over{[BH^+]}} = {{[B]\cdot
K_e...
...ot[H_3O^+]^2}\over{K_e}}=
{{c [H_3O^+]^2}\over{K_e}} \qquad .\end{displaymath}](img65.png)
![\begin{displaymath}K_a = {{[B]\cdot[H_3O^+]}\over{[BH^+]}} = {{[B]\cdot
K_e...
...ot[H_3O^+]^2}\over{K_e}}=
{{c [H_3O^+]^2}\over{K_e}} \qquad .\end{displaymath}](img65.png)
![$[H_3O^+] = \sqrt{K_a K_e / c}$](img66.png) ou bien
ou bien
![]() nous écrivons
nous écrivons
![\begin{displaymath}K_a = {{[B]\cdot[H_3O^+]}\over{[BH^+]}} =
{{c(1-\alpha)K_...
...,c}} \
\rightarrow \alpha=\sqrt{{K_e}\over{K_a c}}\end{displaymath}](img68.png)
![\begin{displaymath}[H_3O^+] = {{K_e}\over{\alpha c}} = \sqrt{{K_a K_e}\over{c}} \qquad \end{displaymath}](img69.png)