| (1) |
| (1) |
Si l'on néglige la présence des ions ![]() et l'autodissociation de l'eau
le tableau d'avancement de la réaction s'écrit comme
et l'autodissociation de l'eau
le tableau d'avancement de la réaction s'écrit comme
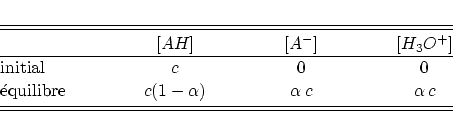
En utilisant le définition de la constante de l'acidité ![]() nous pouvons
commencer directement à calculer le pH d'une solution de concentration
intiale
nous pouvons
commencer directement à calculer le pH d'une solution de concentration
intiale ![]() :
:
![$\displaystyle {{\left[A^-\right]\cdot\left[H_3O^+\right]}\over{\left[AH\right]}}=
{{\alpha^2 c}\over{1-\alpha}}$](img14.png) |
(2) | ||
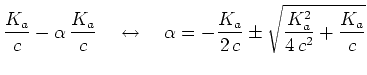 |
(3) | ||
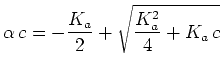 |
(4) |
Pour ne pas négliger l'équilibre
![]() nous devrons
inclure les ions
nous devrons
inclure les ions ![]() dans le raisonnement; nous disposons ainsi de quatres
équations pour travailler :
dans le raisonnement; nous disposons ainsi de quatres
équations pour travailler :
Un piège est l'équation 8, elle n'est valable que dans le
cas d'un acide, où ![]() est plus grand que
est plus grand que ![]() , puisque
, puisque ![]() .
.
De ces quatre équation nous éliminons ![]() ,
, ![]() et
et ![]() pour ne
garder que
pour ne
garder que ![]() ,
, ![]() ,
, ![]() et
et ![]() , c'est-à-dire le pH, la condition
initiale
, c'est-à-dire le pH, la condition
initiale ![]() et des constantes. Eq. 8 devient avec éq. 7
et des constantes. Eq. 8 devient avec éq. 7
Cette dernière équation contient la solution exacte du pH à partir de
![]() ,
, ![]() et
et ![]() , mais elle est lourde à manipuler. Par la suite nous
proposons plusieures possibilités de la ramener à des approximations
simples. Pour cela nous n'egligeons toujours l'autodissociation de l'eau : des
ions
, mais elle est lourde à manipuler. Par la suite nous
proposons plusieures possibilités de la ramener à des approximations
simples. Pour cela nous n'egligeons toujours l'autodissociation de l'eau : des
ions ![]() ou
ou ![]() viennent de la dissociation d'un acide ou d'une base.
viennent de la dissociation d'un acide ou d'une base.