


Next: Base forte
Up: Une note concernant les
Previous: Acide fort
Contraire à la situation d'un acide fort, nous avons pour un acide faible
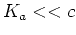 et
et
![$K_a « [H_3O^+]$](img44.png) , mais encore
, mais encore 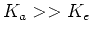 . De l'équation
exacte (éq. 9) il reste
. De l'équation
exacte (éq. 9) il reste
donc
![$[H_3O^+]^2 = c K_a$](img46.png) et
et
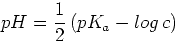 |
(11) |
Un raisonnement alternatif est donné par l'hypothèse que l'acide  est
peu dissocié (
est
peu dissocié (![$[AH]\approx c$](img48.png) ), et
), et ![$[OH^-]$](img27.png) est négligeable (nous avons un
acide, donc
est négligeable (nous avons un
acide, donc
![$[H_3O^+]\approx [A^-]$](img49.png) ). La définition de
). La définition de 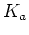 nous amène
à
nous amène
à
avec le même résultat.
On peut utiliser aussi le taux 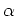 en partant de la définition de
en partant de la définition de
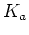 :
:
Une dissociation faible permet de mettre
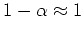 , ce qui
entraîne
, ce qui
entraîne
avec toujours le même résultat pour le pH.
Peter Reinhardt
2006-04-24
![]() est
peu dissocié (
est
peu dissocié (![]() ), et
), et ![]() est négligeable (nous avons un
acide, donc
est négligeable (nous avons un
acide, donc
![]() ). La définition de
). La définition de ![]() nous amène
à
nous amène
à ![\begin{displaymath}K_a = {{[H_3O^+]\cdot[A^-]}\over{[AH]}} = \
{{[H_3O^+]^2}\over{c}} \leftrightarrow [H_3O^+]^2 = c K_a \qquad
,\end{displaymath}](img50.png)
![]() en partant de la définition de
en partant de la définition de
![]() :
:
![\begin{displaymath}K_a = {{[H_3O^+]\cdot[A^-]}\over{[AH]}} = \
{{\alpha^2 c^2}\over{(1-\alpha) c}} = {{\alpha^2 c}\over{1-\alpha}}\qquad
.\end{displaymath}](img51.png)
![\begin{displaymath}\alpha = \sqrt{{K_a}\over{c}} \rightarrow [H_3O^+] \
= \alpha c = \sqrt{K_a c}\end{displaymath}](img53.png)