La réaction, par échange de deux électrons par ion transformé, est
Les potentiels standards respectifs sont
| (6) |
Puisque les concentrations intiales sont égales, nous pouvons attribuer tout
de suite le sens de la réaction globale : il y a production de ![]() et
consommation de
et
consommation de ![]() .
.
![]() est
négatif, alors, pour le mener à zéro il faut augmenter la concentration
en
est
négatif, alors, pour le mener à zéro il faut augmenter la concentration
en ![]() et diminuer la concentration en
et diminuer la concentration en ![]() . Le pôl positif de la
pile sera au fer (consommation d'électrons par
. Le pôl positif de la
pile sera au fer (consommation d'électrons par
![]() ), et le pôle négatif au zinc.
), et le pôle négatif au zinc.
Par un tableau d'avancement nous pouvons écrire
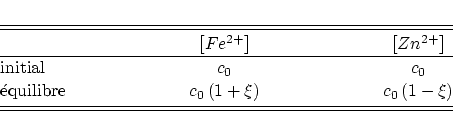
et la f.e.m. s'exprime alors en fonction du paramètre d'avancement ![]() comme
comme
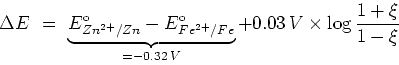 |
(7) |
Le transfert d'électrons est directement proportionnel au paramètre
d'avancement :
![]() .
.
Il faut encore calculer la valeur de ![]() à l'équilibre. Pour cela nous
utilisons la condition d'équilibre
à l'équilibre. Pour cela nous
utilisons la condition d'équilibre
![]() , c'est-à-dire
, c'est-à-dire
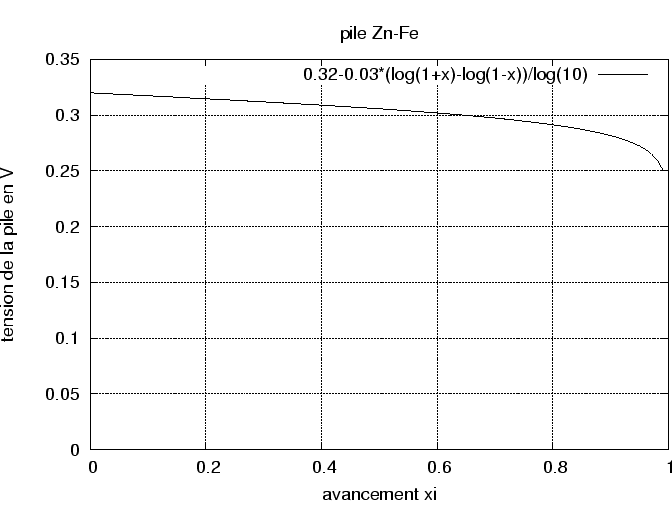
La tension de la pile baisse très peu jusqu'à environ 95% de sa
capacité totale. Par ailleurs, si l'on applique une tension extérieure
égale à la tension initiale et dans le sens opposé (![]() au zinc et
au zinc et ![]() au fer), on
va inverser le sens du courant et recharger la pile.
au fer), on
va inverser le sens du courant et recharger la pile.